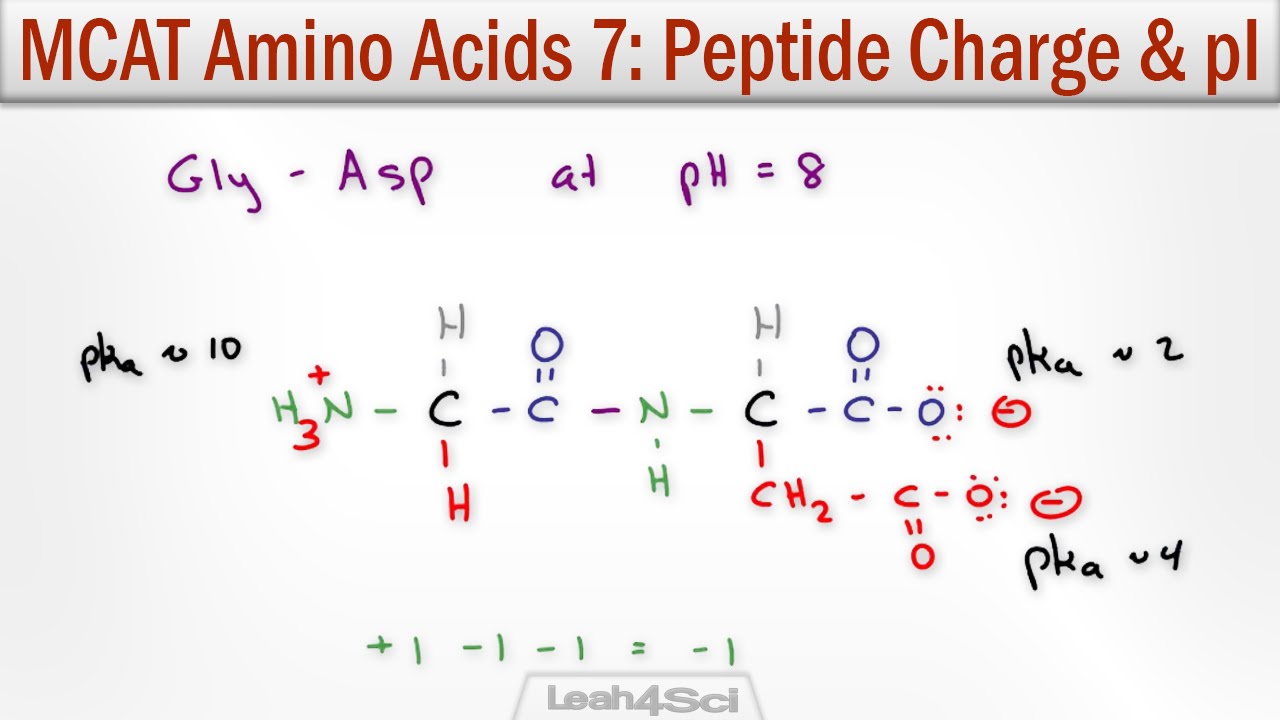
Здраствуйте, пытался читать в McMurry, искать в Leninger’е а также читал это же на этом сайте но не понял как решать такого типа задачи
советую посмотреть это видео так как лучше самому найти решение с помощью теормата
если не понятно то можно спросить заново и кто то ответит)
Давай сначала определимся, какие формы бывают у лизина. Судя по таблице, лизин имеет четыре формы H_{3}L^{2+} , H_{2}L^{+} , HL , L^{-}. Для полного понимания и удобства, на картинке ниже я привел структурную формулу для каждой формы :
Теперь, предложу один из подходов для решения таких задач без прибегания к количественным расчетам. Вообще, что такое pK_{a} ? Все мы скажем, что это константа кислотности. Однако, если так подумать, то значение pK_{a} равно значению pH, при котором концентрации протонированной и непротонированной формы молекулы равны друг другу.
Покажем это на примере H_{3}L^{2+} :
Константа равновесия для этой диссоциации по первой ступени имеет вид K_{a,1} = \frac{[H_{2}L^{+}][H^{+}]}{[H_{3}L^{2+}]}. Так как pK_{a,1} = pH , K_{a,1} = [H^{+}]. И в принципе, тогда и получится, что \frac{[H_{2}L^{+}]}{[H_{3}L^{+}]} = 1
Что это нам дает в итоге ? Думать надо в таком ключе : диссоциация - равновесный процесс. Если мы увеличим концентрацию [H^{+}] (эквивалентно уменьшению значения pH) , равновесие сместится в сторону протонированной формы молекулы. Если мы уменьшим концентрацию [H^{+}] (эквивалентно увеличению значения pH) , равновесие сместится в сторону непротонированной формы молекулы. Отсюда следует, что если pH > pK_{a} , то преобладать будет непротонированная форма молекулы, а если pH < pK_{a} , то преобладать будет протонированная форма молекулы.
Я покажу лишь пункт (а) , а остальные пункты лучше будет оставить на тебя самого.
В пункте (а) pH = 2 , и судя по табличным значениям констант кислотности лизина, pH < pK_{a,COOH} ; pH << pK_{a,NH_{3}^{+}} ; pH <<< pK_{a, R} (я взял что чем больше стрелок, тем больше разница). Это значит, что преобладать будет лизин в форме H_{3}L^{2+}.
Значит конечный ответ = +2
А эту задачу можно решить не зная форму лизина? Просто я помню что ее решали с помощью какой-то формулы но ее я запомнить не успел
Знать структуру лизина не обязательно, потому что в задаче даются константы для всех групп, которые участвуют в кислотно-основном равновесии, чего достаточно для ответа на вопросы. Первые две колонки показывают значения для \ce{-COOH} и \ce{-NH3+} соответственно. Третья колонка показывает значение для \ce{-NH3+} группы в side chain. То, что это аминогруппа, а не карбоксильная, можно понять по тому, что значение pK^\prime для нее высокое.
Ну и дальше смотрим: значение 2.0 меньше, чем все остальные константы, поэтому все группы протонируются, значит в первом случае заряд +2. Значение 5.0 выше константы для кислотной группы, но ниже остальных, значит другие группы будут протонированы, а кислотная будет депротонирована — заряд +1. Значение 7.0 тоже выше константы для кислотной группы, но ниже остальных, поэтому заряд такой же — +1.
Надо просто понимать, что когда кислотная группа депротонирована, она имеет отрицательный заряд; когда аминогруппа протонирована, она имеет положительный заряд; а в иных случаях группы нейтрально заряжены.