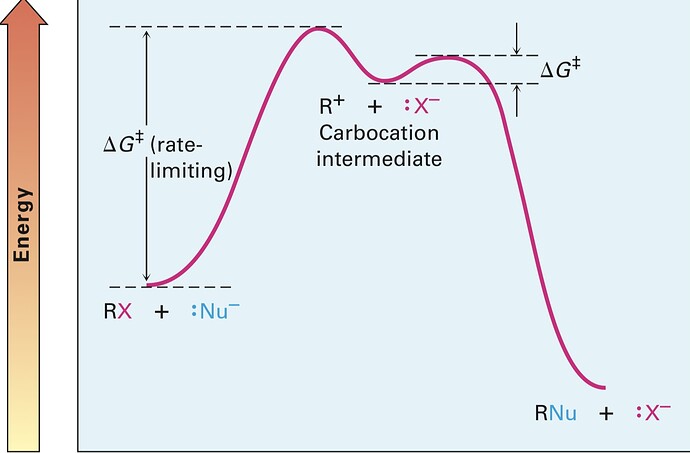
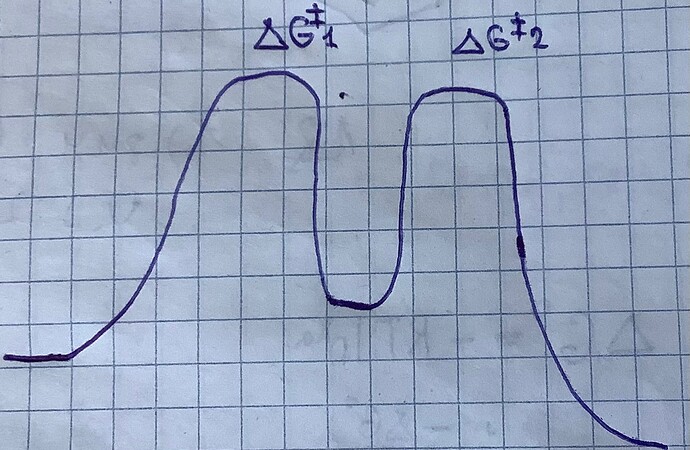
Почему шаг определяющий скорость, это именно самое большое переходное состояние? Имею ввиду да, в первой картинке dG++ у первого шага намного больше чем у второго шага, и поэтому сперва медленно произойдёт первый шаг, а потом по быстрее второй, но что если будет как во второй картинке, первый шаг к примеру требует 100 KJ, а второй допустим 95 KJ, в таком случае скорость все равно будет определять первый шаг? Типо первый шаг идёт медленно, но второй шаг тоже идёт медленно и таким образом вообщем скорость должна быть медленнее, чем если бы второй шаг был скажем 20 KJ. Может они вообщем имеют ввиду, что скажем например есть 5 шагов, четыре из них в диапазоне от 50-100 KJ, а один 120KJ а значит мы должны всей системе давать поток энергий как минимум 120KJ, независимо от того на каком этапе этот самый 120 KJ шаг, при этом остальные шаги, которые требует меньше энергий будут идти очень быстро так?
Да
Снова сделаю отссылку на предыдущую дискуссию
Иными словами, если молекула обладает достаточной энергией, чтобы преодолеть самый высокий барьер, то у нее достаточно энергии, чтобы преодолеть любые более низкие барьеры.
Ну и не забываем, что скорость реакции пропорциональна количеству молекул, обладающих энергией выше или равной энергии активации (лимитирующей стадии).
Т.е.
А вот если скажем есть 2 шага, первый требует 100 кДж, а второй 90 кДж, у молекулы есть энергия в 100 кДж или больше, то она сперва медленно пройдёт первый шаг, а потом очень быстро второй? Да так быстро, что мы ее скорость не учитываем.
У меня вот такой вопрос возник, сверху диаграммы двух реакции у которых одинаковый rate limiting step , очевидно что вторая реакция будет идти медленее, но ведь самая большая энергия активации у них одинаковая, а значит и скорости одинаковые?
Молекула не проходит шаги «медленно» и «быстро». Она либо проходит (обладает достаточной энергией), либо нет. Молекулы не ходят по вот этим диаграммам вверх вниз.
Молекулы не катаются на американских горках.
Поэтому скорость реакции не определяется тем, как быстро молекула забирается на нарисованный барьер. Скорость реакции определяется тем, какая доля молекул имеет достаточную энергию, чтобы барьер преодолеть.
Значит если мы допустим подогрели раствор до нужной температуры, которая даёт необходимое количество энергий, то значит доля молекул способных на реакцию близко к 100%?
Насчёт тех двух диаграмм, значит если мы обоим растворам дадим необходимое количество энергий, то они будут проходить с одинаковой скоростью?
Доля молекул зависит от того до какой вы температуры нагрели (см. уравнение выше). И совершенно необязательно, чтобы доля была близка к 100% чтобы реакция происходила.
Скорость не обязательно будет равной, там ведь не только энергия активации влияет (размер молекул, частота столкновений, стерический фактор).
Но в любом случае скорость определяется самым высоким барьером