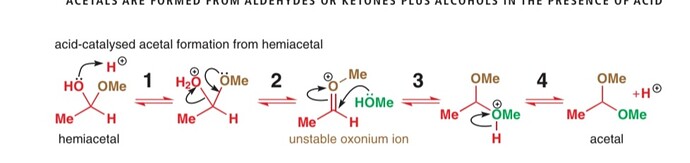
на первой стадии протонируется либо метоксильная(что возвращает реакцию к альдегиду и спирту) либо гидроксильная группа. pKa (MeOH2+)=-2.2, pKa(H30+)=-1.7 то есть метанол это более хорошая уходящая группа, чем вода, тогда в большинстве случаев реакция будет идти к альдегиду, а не к ацеталю, правильно же? Насколько влияет, какой именно спирт мы берем, например pKa (EtOH2+)=-2.5, то есть еще менее вероятнен уход воды?
По факту, да
Тоже да
Мне кажется, вопрос который ты хочешь задать: “Если в этих стадиях у нас скорее образуется альдегид, то как тогда мы получаем ацетали?” Во-первых, как ты видишь из стрелок реакций, они у нас обратимые, то есть здесь доминирует термодинамический контроль. Значит если мы добавим избыток метанола и еще нагреем немного, то сможем сдвинуть равновесие в сторону ацеталя. Во-вторых, альдегиды и кетоны чаще превращают в цикличные ацетали, так как они служат очень сильной защитной группой. Это является плюсом для образования ацеталя, так как стадия номер три проходит намного быстрее за счет внутримолекулярности реакции, а также циклические ацетали (5, 6 членные) термодинамически стабильнее, чем ацикличные.
Ы, это только в рамках приближения, что pKa можно считать прокси для силы химической связи. Но даже с ним не все так однозначно:
- Уходит протонированная группа. Либо \ce{H2O}, либо \ce{MeOH}. Значит для начала нам нужно равновесие, в котором эта группа протонируется. Т.к. гидроксоний менее кислый, он будет протонироваться первым. Т.е. в равновесии будет преобладать \ce{-OH2+}, а не \ce{-O+HMe}.
- Запишите уравнение реакции для ухода воды и метанола. Если будет уходить метанол, он будет среди продуктов, т.е. K \sim [MeOH]. Но у нас метанол в избытке и даже если K для ухода метанола выше, чем для ухода воды, за счет высокого [MeOH], уходить будет именно вода.