Хотел бы уточнить один момент, знаю неуверенность - это плохо, однако:
Так как изменение внутренней энергии - функция состояния, то т.е. если мы поставим давление и температуру до определенных значений - а затем снова изменим их к тем же значениям что и изначально были - получится что изменение внутренней энергии будет равно нулю - т.к. функция состояния и от пути не зависит?(В книге написано что “…Изменение внутренней энергии останется тем же изначально…”).
И вот еще:
“The generation of work by a burning fuel, in contrast, relies
on a carefully controlled transfer of energy so that vast
numbers of molecules move in unison.”
Как переводится, и можете объяснить пожалуйста(если я конечно правильно понял предложение) - как можно получать энергию для перевода в работу, полученную путём передачи энергии путём горения топлива, т.е. передачи энергии путём тепла? Атомно-молекулярно ведь - пути передачи тепла и работы, кардинально разные - в первом крайне упорядоченные в унисон атомы двигаются против внешних сил, а во втором хаотично двигающиеся атомы передвигаются.
И третий вопрос который подкрепит моё понимание теплоёмкости математически, это:
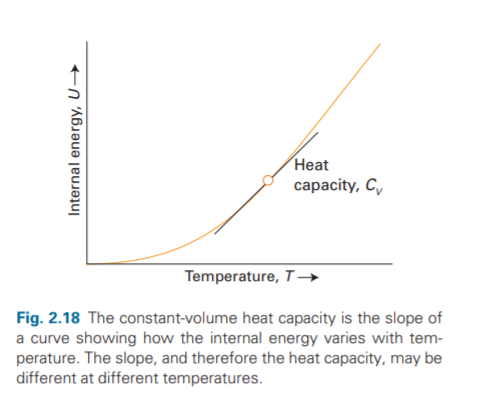
если теплоёмкость по графику(фото первое) соответствует формуле(фото второе)
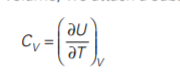
то этой формуле без бесконечно малых величин:(фото третье)

будет соответствовать теплоёмкость по графику:(фото четвертое)

?
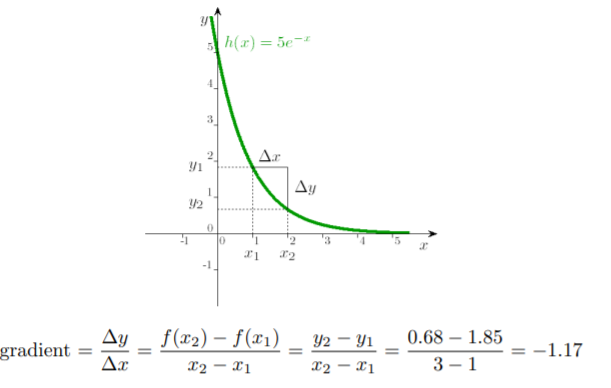
Я это представил себе по причине того что у нас не имеется бесконечно малых величин и математически мы используем получается не дифференциалы, а методы треугольника:(фото пятое)
Надеюсь мои вопросы помогут и вам повторить и напрячь мозги.
Совершенно верно. В книгах еще можно увидеть подобные обозначения \displaystyle\oint \text{d}U = 0, что означает интеграл по всему циклу — ровно тот же процесс, который ты назвал.
Здесь автор сравнивает передачу тепла и совершение работы, говоря, что второе, по сравнению с первым, основывается на том, что большое количество молекул движется в одном направлении, а не хаотично.
В том же параграфе автор приводит в пример паровой двигатель. Мы можем взять какой-то сосуд, поместить в него топливо и закрыть его поршнем. Когда система достигнет равновесия, поршень не будет двигаться. Но если мы подадим тепло в этот сосуд, в нем увеличится давление за счет испарения. И тогда система уже не будет в равновесии, а значит поршень должен куда-то подвинуться. И он подвинется так, чтобы объем внутри сосуда увеличился. Получается, подав тепло, мы достигли того, что поршень сдвинулся — газ совершил работу.
И то и другое — формы энергии, а первый закон термодинамики (или просто закон сохранения энергии) гласит, что энергия не может получиться из ничего, ровно как и исчезнуть в никуда; энергия может только переходить из одной формы в другую.
Последний твой вопрос я не особо понял, но попытаюсь что-то сказать. Разница между \displaystyle \left( \frac{\partial U}{\partial T} \right)_V и \displaystyle\frac{\Delta U}{\Delta T} при постоянном объеме действительно в том, что в первом случае мы подразумеваем бесконечно малые изменения величин. Будет ли одно совершенно точно равняться другому — нет. Но второе выражение будет тем ближе по значению к первому, чем меньше будут изменения величин. В каких-то случаях такой точности достаточно и можно посчитать \displaystyle\frac{\Delta U}{\Delta T}. В каких-то случаях (например, если в последнем графике взять x_1 = 1 и x_3 = 5) это будет слишком неточно, поэтому нам надо будет искать зависимость U = f(T, V) и использовать немного больше математики.
Спасибо огромное! Вы правда помогли понять всё, а последний вопрос - вы всё расставили по полочкам, спасибо вам.
Очень рад, что смог помочь!