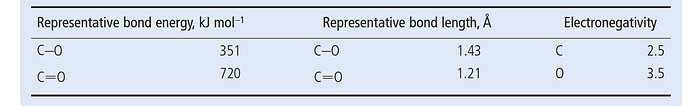
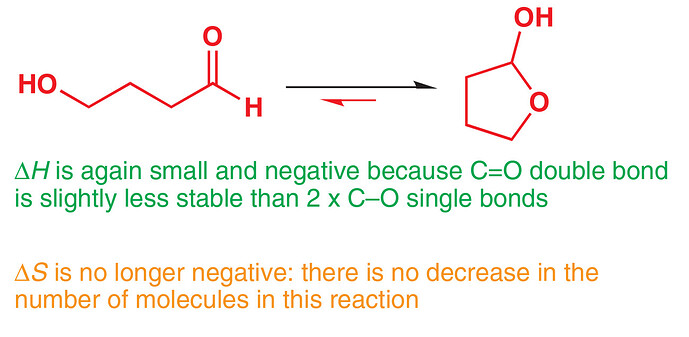Двойная связь С=О покрепче, чем две С-О связи
По этой причине альдегид стабильнее?
Почему каждый раз как вы спрашиваете “почему яблоко не желтое?” и вам отвечают “яблоко зеленое” вы переспрашиваете: “яблоко не желтое потому что оно зеленое, да?”. Если говорится что яблоко зеленое, вы не можете провести логическую цепочку?
Такое ощущение будто вы заучиваете предложения без понимания их смысла.
В голове была мысль блин, точно солай ма, или наоборот, и открыл 12ую главу клейдена
У нас похожая ситуация, только наоборот: из двух С-О получаем одну С=О, значит изменение энатльпии у нас положительное. Изменение энтропии нулевое, тогда изменние энергии Гиббса положительное
P.S.: на картинке написано \Delta H is small and negative, получается напряжение спокойно компенсирует это маленькое значение \Delta H
Согласен, что в данном случае снятие этого напряжение играет немаловажную роль в этой реакции, но данная перегруппировка изначально использовалась с 1,2 диолами, где такого ring strain’a нет. А значит, что-то другое движет реакцию.
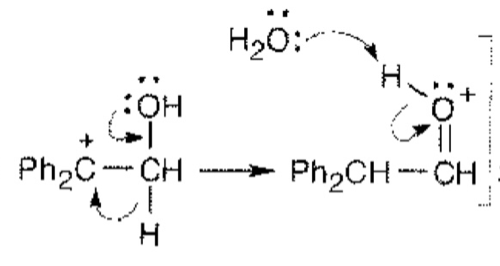
А вот с этим я не согласен. Ты тут рассматриваешь только конечный продукт и начальный реагент, и сравниваешь связи, но совсем забываешь про механизм. Допустим наша молекула элиминировала воду, и у нас получился карбокатион. Есть два выхода:
Первый, вода опять присоединится и ничего не произойдет.
Второй, более интересный случай: У карбокатиона вокруг всего 6 электронов, и как бы понятно, что электронов ему не хватает. Вот тут и играет ключевую роль образование двойной связи. За счет того, что кислород своей НЭП выталкивает одну из групп к плюсу на соседнем углероде у всех образуется октет, что значительно стабильнее прежней молекулы. А когда он образуется, пути назад уже нет, то есть в этой стадии реакция необратима. Поэтому я и применил слово “движущая сила”
Тут можно логично возразить и сказать: “Так это все равно не изменяет того факта, что энтальпия реакции положительная” НО есть еще и энтропия, о которой не стоит забывать. В результате реакции мы грубо говоря получаем, что наша молекула немного видоизменилась и выкинула воду, поэтому изменение энтропии положительная. Тут уже понятно, что при нагревании dG будет минус.
Ты тогда сново можешь сказать: “Ну тогда движущая сила энтропия”. И это как бы на первый взгляд правда, но истина (по крайней мере для меня) в том, что именно двойная связь с кислородом делает эту перегруппировку возможной.
Именно это стадия, на всякий случай.
Можно и без механизма рассматривать (если нам интересна термодинамика), и брать только начальное и конечное
Просто он забыл про воду в конечных продуктах
А я бы серьезно задумался нет ли тут опечатки. По крайней мере, средняя BDE двойной связи все таки больше, чем две BDE одинарной связи. И тут также.