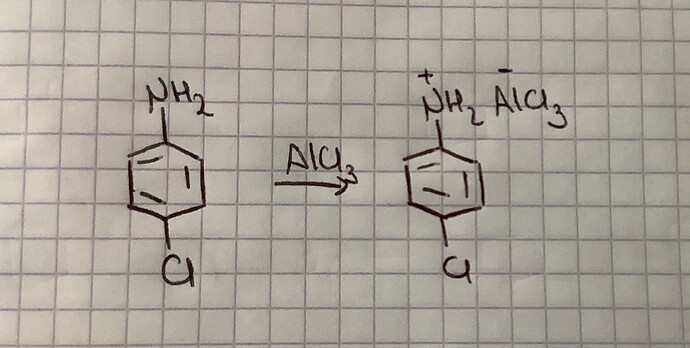
Тут пишут, что реакция алкилирования анилина не может происходить, ведь образует какой-то комплекс, что деактивирует кольцо, мой вопрос такой: Какой именно образуется комплекс, почему он деактивирует кольцо, а также почему именно NH2, в чем ее отличие от той же ОН, у которой тоже есть нэп и она активатор?
AlCl3 Lewis acid и он просто принимает электронную от азота. А реакция деактивируется потому что тупо нету катализатора, он в комплексе.
Если AlCl3 кислота Льюиса, то значит любой заместитель имеющий нэп будет выступать в качестве основания Льюиса и деактивировать кольцо? И ещё вы уверенны, что деактивация происходит из за того, что кончается катализатор, а не из за того, что азот стал положительно заряженным, вследствие чего будет meta-directing deactivator ( любой положительно поляризованный атом прикреплённый непосредственно к ядру, будет направлять реакцию на мета позицию), а как мы знаем, мета направляющие заместители ниже по энергий чем галогены, а алкилирование не происходит, когда кольцо ниже по энергий чем галогеннозамещенный бензол.
Не любой. Например, кислород фенола не образует этот комплекс. Это из за того что азот более нуклеофильнее(тоесть sp3 азота выше по энергий чем sp3 кислорода)
Я так и не понял в чем причина того, что среди всех именно азот самый нуклеофильный
У азота меньше протонов, чем у кислорода. Соответственно, его эффективный заряд ядра меньше. Вследствие чего, электроны притягиваются к ядру азота хуже, чем к ядру кислорода. Соответственно, азот легче теряет НЭП
Что вы подразумеваете под «эффективный заряд»? И ещё так можно делать со всеми атомами, скажем фтор менее нуклеофильный, ведь большая часть его электронов притягивается ядром?
Так как электроны отрицательно заряжены, они притягиваются к положительно заряжённому ядру. И так как протонов в кислороде больше, то его эффективный заряд ядра будет больше, то есть у него бОльший плюс на ядре. От этого электроны более крепче держатся на кислороде. Так что, да, НЭП в sp3 фтора будет менее нуклеофильной, чем НЭП в sp3 азота
Ну так с увеличением кол-во протонов, увеличивается и кол-во электронов, вследствии чего ничего не должно меняться. И что насчёт какой-нибудь серы, у которой в два с лишнем раза больше протонов, чем у азота
Может ли быть дело еще и в том, что у кислорода две пары, и если одна занята на образование комплекса, вторая продолжает сидеть в кольце?
А у азота всего одна пара, и та в кольце, поэтому если комплекс с азотом образуется, то резонанс рушится.
Прочитайте главу в Хьюи по поводу комплексов Льюиса, там много интересного написано
Правильнее сказать: Если AlCl3 кислота Льюиса, то значит любой заместитель имеющий нэп может взаимодействовать с этим AlCl3. Будет ли это влиять на кольцо зависит от того есть ли другие электронные пары на этом же атоме и насколько сильно они изначально были делокализованы в кольцо.
это тоже фактор
не, я такого не знаю. Мета-направление лишь следствие более фундаментальных причин.
Эффективный заряд внутри одного атома разный для разных орбиталей. Поэтому здесь имхо не очень правильно говорить об общем эффективном заряде. Достаточно вспомнить, что 2s/2p орбитали азота выше по энергии, чем такие же орбитали кислорода.
Тоже не совсем верно. При движении по периоду, добавление нового электрона не компенсирует (из-за экранирования других электронов) возрастание заряда ядра и отсюда следует уменьшение атомного радиуса при движении по периоду.
И электроны у нее на третьем уровне, гораздо дальше от ядра.
Значит ли это, что предпочтительнее образуется комплекс с тем атомом, что имеет не больше одной нэп, и сильно отдаёт ее кольцу?
В книге все мета-направляющие заместители были ниже по энергий чем галогены
Причина этого в том, что на орбиталях азота меньше электронов?
Вы про Дж.Хьюи неорганическая химия?
Вам придется вернуться в самое начало изучения химии, к строению атома. Тоже есть в Хьюи (да и в любом учебнике по неорганике/органике).
Да
Нет, не значит. То что я сказал означает, что факт образования комплекса будет иметь большее значение на процесс электрофильного присоединения, если НЭП участвующая в образовании комплекса играет более важную роль (например, она участвует в делокализации и (или) она единственная НЭП).
Мета-направление определяется EWG характером функциональной группы (ибо тогда она дестабилизирует положительный заряд при орто- и пара- атаке). Действительно, орбитали EWG групп по сравнению с орбиталями EDG групп ниже по энергии, но я бы не стал делать вывод что мета-EWG ниже всех других, ибо я почти уверен, что какой-нибудь галоген может быть ниже некоторых EWG групп.
Но даже если мы захотим сделать вывод, мы скажем: «орбитали EWG групп, как правило, обладают низкой энергией, а поэтому попытки забрать оттуда электрон (для делокализации, при орто\пара атаке) приводят к дестабилизации молекулы, поэтому атака происходит преимущественно по мета- положению, в результате которой не образуется резонансная структура с делокализацией положительного заряда на EWG группе». Вот это полный аргумент. Упростить его до “EWG ниже по энергии, поэтому мета” нельзя.
И самое главное, из этого не следует “мета, значит ниже по энергии”. Потому что даже если утверждение “если яблоко неспелое, оно кислое” верное, совершенно не факт что “если яблоко кислое, то оно неспелое”. На языке формальной логики это значит p\implies q\quad \bcancel{\implies} \quad q \implies p .
В очередной раз рекомендую:
Нет. Причина в том, что энергия валентных орбиталей при движении по периоду слева направо уменьшается (становится более отрицательной). Вызвано это тем, что каждый новый добавленный электрон не нивелирует добавленный протон, т.е. все элекроны притягиваются к ядру сильнее. Это же вызывает уменьшение атомного радиуса при движении по периоду.
Значит если нэп сильно делокализована по кольцу и/или она единственная нэп, то ее можно считать «важной»? И только такие «важные» нэп могут образовывать комплексы? В чем причина?
Значит, так как азот имеет больший радиус чем кислород, он меньше стягивает на себя электронную плотность, и тем самым является менее стабильным чем тот же кислород, следовательно более реакционноспособным и нуклеофиольным?
Нет. Любые НЭП могут образовывать комплекс. Еще раз говорю, суть в том, что образование комплекса влияет на реакционную способность в разной степени. Если у вас реакционная способность определялась наличием электронной пары у азота, которая была делокализована по кольцу, а потом вы эту пару забрали – эффект значительный. Если реакционная споосбность определяется наличием одной НЭП у кислорода, а при этом другая нэп образует комплекс, то да, конечно электронная плотность на кислороде меняется и реакционная способность изменится (как?), но эффект будет не таким же значительным, как в случае азота.
Я не вижу какая прямая связь есть между способностью стягивать электронную плотность и радиусом атома. (Какие промежуточные утверждения вы пропустили?)
а вот это точно нет. Хотя бы потому, что стабильность понятие относительное, и я не понимаю, что вы имеете в виду в данном случае. Валентные пары азота выше по энергии, поэтому они более реакционно способные. Называть азот из-за этого менее стабильным я бы не стал.