Они правильно расставили их по порядку стабильности? Просто вроде как sp2-sp3 связь сильнее, чем sp3-sp3 связь, и следовательно карбокатион у которого побольше sp2-sp3 связей тот стабильнее, чем тот у кого sp3-sp3 связи. А значит самый стабильный карбокатион это тот (в этом случае), который сам sp2 гибридизован. Можете объяснить в чем я не прав.
Посчитайте кол-во sp2-sp3 и sp3-sp3 связей скажем в а) у secondary vinyl и secondary
вообще большая доля s-орбитали(т.е. когда гибридизация sp/sp2 а не sp3) стабилизирует карбанионы, например ацетилен гораздо охотнее отдает протон чем какой-нибудь этан, так как находится в sp гибридизации. А для карбокатионов все будет наоборот и самым стабильным будет тот, где атом углерода находился в sp3 гибридизации, и например среди вторичного винильного и просто вторичного катиона стабильным будет тот, который был гибридизован в sp3 то есть обычный. Мне кажется так логичнее это обьяснить
У secondary две связи sp3-sp3, а у secondary vinyl одна sp2-sp3, а другая sp2-sp2.
А почему для карбокатионов все наоборот? Если карбокатион сам sp2 гибридизован, то электроны со связи будут близко расположены к атому, тем самым стабилизируя положительный заряд. Разве не так? И ещё, раз уж тем больше sp3-sp3 связей, тем стабильнее карбокатион, то почему sedondary with resonance стабильнее чем просто secondary, ведь у него есть одна sp2-sp3 связь. Это из за резонанса? А разве резонанс есть не у всех?
Морализаторство
Скажу сразу – вот такая манера отвечать коротко и не ясно входит в привычку, что потом на респе таким боком выйдет, вы столько баллов потеряете. Спросите @Madsoul @SanzharB @benzolgirl @Nurgaliyev1 сколько они баллов потеряли на отборочной олимпиаде из-за вот таких формулировок.
Что с формулировкой не так?
Какие две? Где они? Где их нет?
Какая одна?
Какая другая?
Какой ответ я ждал
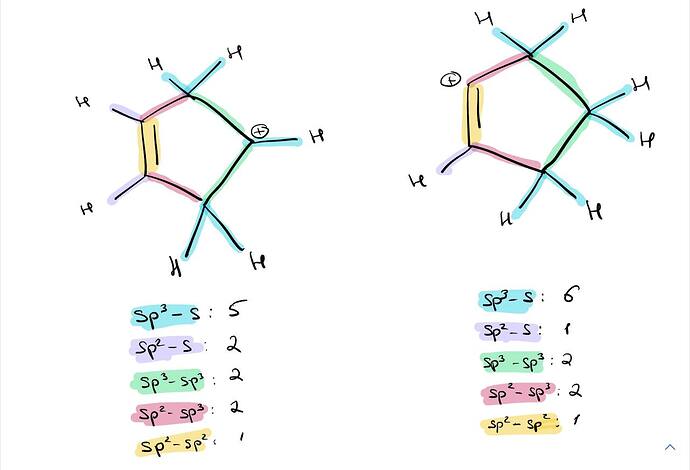
Определим характер ВСЕХ связей. Поскольку у меня есть некоторый опыт, я могу сразу определить какие связи имеют одинаковый характер в обоих случаях, а значит могу их просто не обозначать (вам рекомендую определить характер всех связей).
Иными словами, я заявляю, что вся разница между двумя молекулами показана ниже (вы должны понимать почему это так)
Теперь, сделаем таблицу:
| Изомер | № sp^2-sp^3 | № sp^3-sp^3 |
|---|---|---|
| secondary | 2 | 1 |
| secondary vinyl | 1 | 2 |
А теперь, вспоминая вашу аргументацию:
Делаем вывод, что стабильнее secondary карбокатион.
Возможно, но у него проблема была не в неправильной логике, а в недостаточной внимательности.
Нет, не так. У @elprimo неплохие мысли, но они скорее следствие более фундаментальных причин.
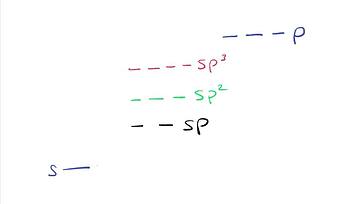
Фундаментальная причина такая. Во-первых, вспомним, что s орбитали ниже по энергии, чем p орбитали. Значит любой гибрид sp^x будет иметь энергию выше, чем энергия s орбиталей, но ниже, чем энергия p орбиталей. И энергия sp^x будет тем ближе к энергии p орбиталей, чем больше будет значение x. Тоже самое, только картинкой:
Теперь, когда мы образуем карбокатион, мы освобождаем одну из заполненных sp^x орбиталей. Заметим, что чем меньше x, тем ниже орбиталь по энергии, а значит, нужно больше энергии, чтобы освободить ее.
Отсюда и видим, что для ионизации sp углерода надо гораздо больше энергии, чем для sp^3 углерода.
Что происходит когда мы образуем карбанион? Мы кладем электроны на углерод. На какой орбитали электронам лучше сидится? Та, что ниже по энергии. Какая ниже по энергии? Та, у которой меньше x.
Именно поэтому карбокатионы стабильнее на sp^3, а карбанионы на sp.
Здесь есть интересное мнемоническое правило. Что характеризует электроотрицательные элементы (например, фтор)? То, что их орбитали расположены низко по энергии. Пойдем от обратного: можно сказать, что чем ниже орбиталь по энергии, тем более она “электроотрицательна”. Поэтому иногда говорят, что sp углерод более электроотрицателен, чем sp^2, а тот в свою очередь более электроотрицателен, чем sp^3.
Извините, а разве углерод который был скажем sp2 гибридизованным, а потом стал карбокатионом не остается все так же sp2 гибридизованным? В той картинке, которую вы показали, secondary карбокатион соединен с двумя углеродами, а значит там две sp3-sp3 связи, к тому же ещё две sp2-sp3 связи, которые подчеркнули ранее. Так же в твой картинке, которую вы показали, secondary vinyl карбокатион соединен с одним sp3 гибридизованным углеродом, а значит в дополнение к той sp2-sp3 связи которую вы подчеркнули, есть ещё одна, и того две sp2-sp3 связи и две sp3-sp3 связи. Вообщем разве и в secondary и secondary vinyl не одинаковое количество sp2-sp3 и sp3-sp3 связей? В дополнение спрошу, разве стабильнее тот у кого много sp2-sp3 связей, и не важно где они, или все же важно, чтобы они были поближе к карбокатиону?
В данной дискуссии это не релевантно, но допустим да.[1]
Что это значит? Какими двумя углеродами? Как карбокатион может быть соединен с двумя углеродами? Может атом несущий положительный заряд соединен с двумя sp^3 углеродами?
Да. И что? Эти же две sp^3-sp^3 связи есть и в secondary vinyl карбокатионе, в том же виде, поэтому я их и не указал.
Да, и? Эта же связь, как и в предыдущем случае, есть и в другом карбокатионе.
Это ровно то, что я имею в виду здесь:
Ну вы же сами не уверены в своих словах. Еще раз говорю, возьмите обе структуры, нарисуйте эксплицитно все С-С и С-Н связи, укажите характер каждой, и посчитайте общее количество связей каждого характера. А потом прикрепите фотку и скажите: вот, я посчитал, вот тут их Х, и тут их Х, в чем ошибка?
Я лишь цитировал вашу аргументацию и показал что она не противоречит ряду стабильности) Мне больше нравится аргументация с энергией орбиталей, которую я указал выше. Ибо природа “более стабильных sp^2-sp^3 связей” как раз таки в разнице энергии орбиталей.
На самом деле (я не проверял расчетами) он должен перегибридизоваться, т.к. положительный заряд на чистой p орбитали будет менее дестабилизирующим, чем на sp^2 орбитали (т.к. p орбитали выше по энергии). Т.е. s характер из освобожденной sp^2 орбитали будет перераспределен среди других, заполненных орбиталей. ↩︎
@Sanjaster ну че там, разобрались?
Ну вроде как не совсем, в той картинке у secondary и secondary vinyl связи С-С одинаковые, единственное отличие это характер связей С-Н, связь С-Н это вроде как sp3-s так? Но вы подписали их как будто sp3-sp3 или sp2-sp3. Вообщем, если связь sp3 гибридизованного углерода с водородом C-H можно считать как sp3-sp3 то все понятно, если нет то я не понял.
Хорошее замечание, да.
Но это сути не меняет, потому что в отмеченных связях менялся характер именно углерода, а не водорода.
Никак не могу понять почему вы так не хотите нарисовать рисунок, а не пытаться решить в уме.
Ясно, спасибо, значит карбокатион стабильнее когда sp2 гибридизованные атомы углерода образует больше связей с чем угодно, а не только с другими углеродами.
Так тоже можно сказать, но первопричина все таки в этом
Извините, а есть причины почему так не может быть? Вроде бы хорошее предположение. Ну а так все остальное понятно
как «так»? Обоснование @Sanjaster не может быть корректным хотя бы потому, что оно противоречит тому, что мы наблюдаем: карбокатионы стабильнее на sp^3 углеродах, чем на sp^2/sp. С точки зрения химии, обоснование неправильное потому что не учитывает, что положительный заряд образуется путем освобождения одной из таких орбиталей, где электроны близко к ядру. Т.е. да, существующие связи рады тому, что они связаны с sp^2 углеродом, но положительный заряд на sp^2 орбитали это плохо.
Тут стоит еще заметить, что при образовании карбокатиона на насыщенном центре происходит регибридизация с sp^3 на sp^2, в итоге положительный заряд находится на p-орбитали, которая освободилась в ходе регибридизации. Подобная регибридизация для sp^2 углеродов затруднительна, ибо sp углерод требует линейную геометрию.