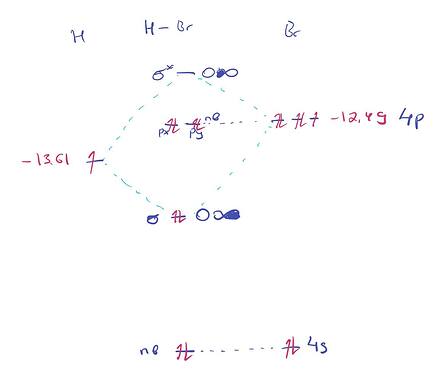
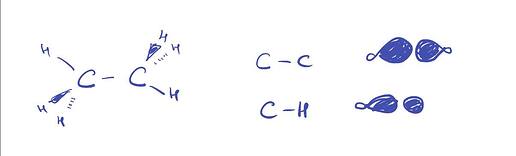
Помогите пожалуйста нарисовать молекулярные орбитали для молекулы этана и бромоводородной кислоты
Рисовал в машине XD
а для атома брома,почему нарисован лишь один электрон? так как все остальные электроны на p-орбитали спарены?
Ну не только на р орбиталях. Там спаренные электроны на s и р орбиталях.
Но так как они не участвуют в взаимодействии орбиталей, я их не рисовал
а вы подскажите, вы для чего спрашиваете? Это задача? Или из собственного интереса?
Потому что полное МО этана довольно огромное.
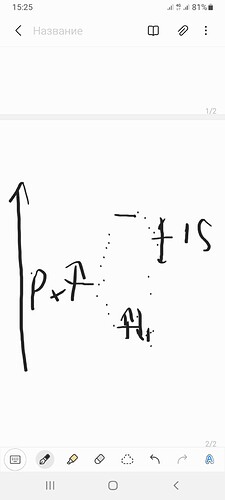
А у меня у самого вопрос. б* двух sp3 углерода выше по энергии чем б орбиталь sp3 углерода и 1s водорода?
Из лично интереса
Вы сравниваете \sigma^* и \sigma?
IE(C)=10.7 eV, IE(H)=13.6
\sigma_{C-H} гораздо ближе по энергии к орбиталям водорода, значит она будет <-13.6.
\sigma_{C-C}^* обязана быть выше орбиталей углерода, значит она будет >-10.7
а равзе сигма разрыхляющая орбиталь не ближе к атомам более ЭО атома?(в нашем случае водорода)
Огромное спасибо
А, стоп. А как это б С-Н ближе к АО водорода? Разве менее электроотрицательный атом водорода не имеет большую энергию 1s АО?
Я привел энергии ионизации 1s H и 2p C выше
Если вы интересуетесь “в общем” и “просто так”, то имхо помимо того как выглядят С-С и С-Н связи вам особо ничего и не нужно
Потому что для полноценной (!) диаграммы МО надо совмещать 6 атомов водорода в D_{3d}, а это немного долго, да и все равно вам эта картинка особо чего не даст (судя по всему у вас мало опыта с теорией МО, а значит диаграммы из трех и четырех атомов вы тоже не видели)
Если хочется самому узнать как рисовать, то советую книгу Харгиттаи “Симметрия глазами химика” там как раз описано как рисовать MO для молекул разных. В какой-то момент ты так преисполнишься, что будешь и без таблиц характеров рисовать их сам
ну наконец-то мы нашли книгу по МО)))