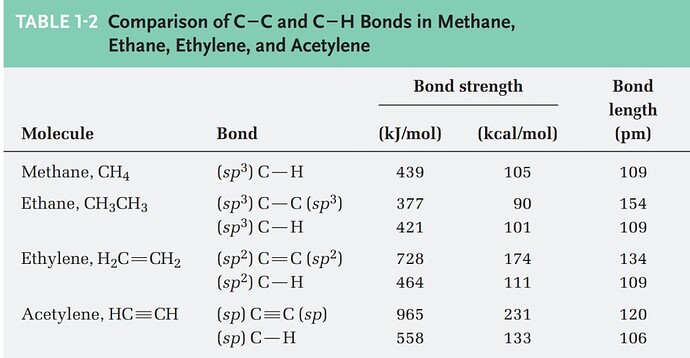
Не могли бы объяснить почему для разрыва C-H связи в sp^2 и sp нужно потратить намного больше энергий чем в sp^3? Это из-за того, что они находятся ближе?(Хотя длина связи C-H не изменяется) И по этому прочнее что бы разорвать связь? Но не будет ли выгодно потерять водород для таких молекул как ацетилен, потом стабилизироваться?
В чем различие между sp^3, sp^2 и sp гибридизациями? Какие связи присутствуют между sp^2 и sp^2 атомами углерода? А sp и sp?
sp^3 имеет 4 сигма связей.
sp^2 имеет 3 сигма связей и свободную p орбиталь
sp имеет 2 сигма связей и 2 свободных р орбиталей
энергия связи, это та энергия, которую надо затратить дабы вернуть электроны с МО обратно на АО. связь будет крепче если ее образуют близкие по энергии орбитали, очевидно что sp² орбиталь ниже по энергии и ближе к орбитали водорода, тогда и связь sp² C-H будет крепче чем sp³ С-Н
В том посте речь шла о карбокатионах, а сила связи определяется как процесс образования радикала - но сути это не меняет.