Морализаторство
Скажу сразу – вот такая манера отвечать коротко и не ясно входит в привычку, что потом на респе таким боком выйдет, вы столько баллов потеряете. Спросите @Madsoul @SanzharB @benzolgirl @Nurgaliyev1 сколько они баллов потеряли на отборочной олимпиаде из-за вот таких формулировок.
Что с формулировкой не так?
Какие две? Где они? Где их нет?
Какая одна?
Какая другая?
Какой ответ я ждал
Определим характер ВСЕХ связей. Поскольку у меня есть некоторый опыт, я могу сразу определить какие связи имеют одинаковый характер в обоих случаях, а значит могу их просто не обозначать (вам рекомендую определить характер всех связей).
Иными словами, я заявляю, что вся разница между двумя молекулами показана ниже (вы должны понимать почему это так)
Теперь, сделаем таблицу:
| Изомер | № sp^2-sp^3 | № sp^3-sp^3 |
|---|---|---|
| secondary | 2 | 1 |
| secondary vinyl | 1 | 2 |
А теперь, вспоминая вашу аргументацию:
Делаем вывод, что стабильнее secondary карбокатион.
Возможно, но у него проблема была не в неправильной логике, а в недостаточной внимательности.
Нет, не так. У @elprimo неплохие мысли, но они скорее следствие более фундаментальных причин.
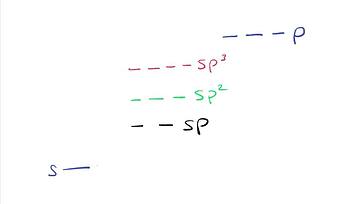
Фундаментальная причина такая. Во-первых, вспомним, что s орбитали ниже по энергии, чем p орбитали. Значит любой гибрид sp^x будет иметь энергию выше, чем энергия s орбиталей, но ниже, чем энергия p орбиталей. И энергия sp^x будет тем ближе к энергии p орбиталей, чем больше будет значение x. Тоже самое, только картинкой:
Теперь, когда мы образуем карбокатион, мы освобождаем одну из заполненных sp^x орбиталей. Заметим, что чем меньше x, тем ниже орбиталь по энергии, а значит, нужно больше энергии, чтобы освободить ее.
Отсюда и видим, что для ионизации sp углерода надо гораздо больше энергии, чем для sp^3 углерода.
Что происходит когда мы образуем карбанион? Мы кладем электроны на углерод. На какой орбитали электронам лучше сидится? Та, что ниже по энергии. Какая ниже по энергии? Та, у которой меньше x.
Именно поэтому карбокатионы стабильнее на sp^3, а карбанионы на sp.
Здесь есть интересное мнемоническое правило. Что характеризует электроотрицательные элементы (например, фтор)? То, что их орбитали расположены низко по энергии. Пойдем от обратного: можно сказать, что чем ниже орбиталь по энергии, тем более она “электроотрицательна”. Поэтому иногда говорят, что sp углерод более электроотрицателен, чем sp^2, а тот в свою очередь более электроотрицателен, чем sp^3.