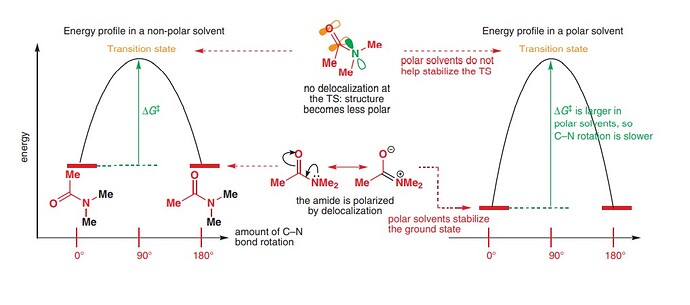
почему в неполярном растворе энергия активаций ниже чем в полярном? Я правильно поняла что это из-за того что неполярное состояние амида более стабильнее чем полярное? Но если это так то как не полярность растворителя может снижать энергия активацию?
Здесь суть в том, что меняется расположение реагента на графике энергии. Переходное состояние в обоих растворителях примерно одинаковое, НО в полярном растворителе амид более стабилен и он находится ниже по энергии, а значит условный “прыжок” в энергии, которую он должен совершить выше. Это как все равно что начать бегать спринт, имея 10 метровую фору.
то есть в не полярном растворе амид сравнительно не стабилен и по этому энергия молекулы немного больше?
Это не два разных состояния, это резонансные формы одной и той же молекулы. Просто правая форма тут нужна, чтобы подчеркнуть, что изначальный амид полярная молекула и её полярность вызвана большим сопряжением
При перевороте, полярность будет временно уменьшаться (т.к. сопряжение исчезает), поэтому правильнее было бы написать не “polar solvents do not help stabilize the TS”, а выразиться точнее “polar solvents stabilize the TS weaker than they stabilize the ground state”