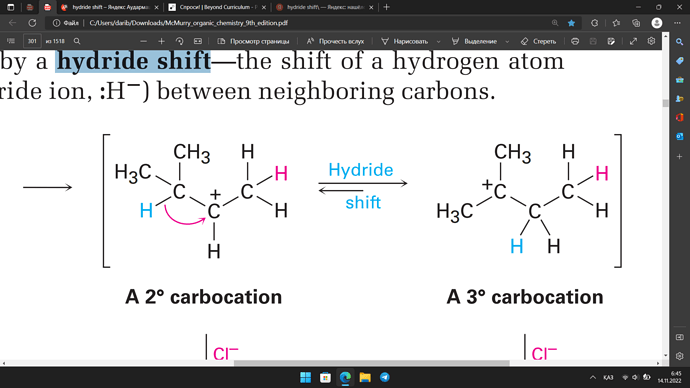
Hydryde Shifting как я понял это сдвиг атома водорода, во время переходного состояния из более стабильного/ замещенного атома к менее стабильному/замещенному атому углероду, это хорошо так как карбокатион становится более стабильным/замещенным, в макмюрри этот сдвиг показан как реакция (см. выше на рисунок) и у меня возникает вопрос: Во время этой перерасстановки выходить или получается энергия системой ?
2 лайка
excuse me, что?
Извините, неправильно сформулировал вопрос. Имею ввиду, что обычно ведь реакций имеют характер эндотермической или экзотермической реакций. И мой вопрос заключался в том, что будет ли hydhyde shifting относиться к одному их этих реакций.
4 лайка
Если в ходе реакции из менее стабильного карбокатиона получается более стабильный карбокатион, \Delta_r G будет положительной или отрицательной?
На самой картинке есть подсказка: длина стрелки прямой и обратной реакции
1 лайк
отрицательной, так как процесс самопроизвольный.
2 лайка
ну, а \Delta_r G = \Delta_r H - T\Delta_r S. Энтропия сильно меняется в ходе реакции? Значит что это говорит о \Delta_r H?
2 лайка
то, что энтальпия станет сильно ниже
2 лайка
ну вот вы и ответили на свой вопрос
значит процесс экзотермический
2 лайка