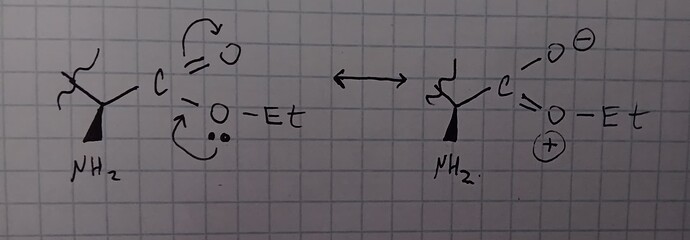
Клейден пишет что рК(ан) аминогруппы понижается из-за эфира. Я всё правильно понимаю, это связано с тем что электронная плотность Азота стянута к положительному заряду? (Ну типа шоб НЭП азота была более недоступной)
Когда азот депротонируется, образуется сопряженное основание, отрицательный заряд которого “размазывается” по карбонильной группе, что и смещает кислотно-основное равновесие в сторону продукта. Это в свою очередь ведет к повышению Ка, а следовательно, понижению рКа
Еще думаю можно объяснить тем, что в обычном амине азот имеет гибридизацию sp3, в то время как азот в амиде имеет гибридизацию sp2. Другими словами, в амиде неподеленная электронная пара азота будет находиться в орбитали с повышенным s - характером, что означает сравнительно лучшее взаимодействие с положительно-заряженным ядром (относительно sp3).
А, нене, я имел ввиду когда азот протонируется (рКа(NH3+)=pKah(NH2)). В этом примере идет сравнение, между влиянием CO2H и CO2Et
Ой тут столько нюансов может быть. Очевидного ответа сразу не найти.
Может быть то, что у эфира больший вклад резонансной структуры \ce{=O+Et} (с положительным зарядом) и положительный заряд дестабилизирует \ce{NH3+}. Может быть там какие-то внутримолекулярные водородные связи, может быть какая-то гиперконьюгация. Может молекула в какой-то особой конформации из-за них.
А разве положительный заряд не должен оттягивать электронную плотность азота? (Тем самым стабилизируя соединение)
-
Катион стабилизируется большей электронной плотностью, не меньшей. Если от азота оттянуть электронную плотность, положительный заряд будет более дестабилизован.
-
Катион стабилизируется делокализацией положительного заряда. Делокализация по сигма связям считай не проходит.
-
Между двумя зарядами с одинаковым знаком действует кулоновское отталкивание. Это та причина, по которой pK_a у поливодородных кислот повышается с каждой стадией диссоциации[1]
-
диссоциация по второй ступени проходит хуже, чем по первой, а по третьей, хуже чем по первой. когда мы диссоциируем, скажем, \ce{HSO4-}, мы добавляем отрицательный заряд к уже отрицательно заряженной молекуле. ↩︎
Большое спасибо! Всё понятно
Там чуточку всё запутанней, т.к. все эти изменения констант в целом сидят в энтропии. Вроде где-то полгода назад тут тоже эта тема поднималась
амин с карбонилом не сопряжены
а, реально. тупанул