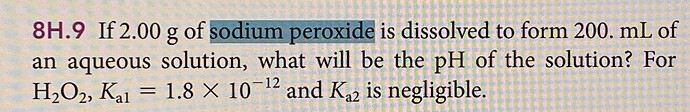Тебе стоит подойти к задаче иным путем. Как ты уже отметила, раствор содержит определенную концентрацию \ce{NaOH}. Это значит, что у нас происходит следующий процесс:
Константа равновесия которого равна \frac{K_{a,1}}{Kw} = 180. До установления равновесия, мы знаем что \ce{[H2O2]_{0} = \frac{2}{23\cdot2 + 16\cdot 2} \cdot \frac{1}{0.2} = 0.1282 \ M}, а \ce{[OH-]_{0} = [H2O2]_{0} \cdot 2 = 0.2564 \ M}. Пусть в реакцию вступило x \ \ce{M} исходных веществ, тогда
Следовательно, \ce{[OH-] = 0.2564 - 0.1231 = 0.1333 M}, а это значит, что \ce{pH = 14 + log_{10}(0.1333) = 13.12}.
Но есть еще один способ решения. Оставлю ниже.
Чтобы решить эту задачу, следует воспользоваться уравнением электронейтральности, а также уравнением материального баланса:
Отсюда следует, что \ce{[HO2-] = \frac{c(H2O2)K_{a,1}}{K_{a,1} + [H+]}}. Также, вспомним что \ce{[OH-] = \frac{K_{w}}{[H+]}}, и в конечном итоге получается, что
Как мы можем заметить, неизвестным в этом уравнении является только \ce{[H+]}, и следовательно, нам имеет смысл попробовать решить это уравнение.
Стоит отметить, что среда у нас будет скорее всего основной, поэтому можно пренебречь концентрацией \ce{H+}. Тогда выражение упростится до
Подставляя известные значения, можно получить квадратное уравнение, решением которого будет \ce{[H+] = 7.51 \cdot 10^{-14} \ M}, что опять-таки дает нам \ce{pH = -log_{10}(7.51 \cdot 10^{-14}) = 13.12}