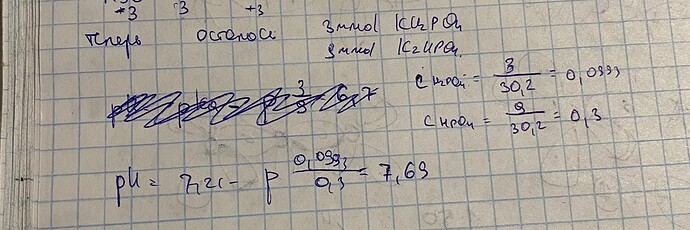Помогите решить задачу, у меня проблема в том что я не понимаю как учесть образующиеся ионы H3O из K2HPO4, они ведь тоже будут стабилизировать раствор взаимодействуя с OH щелочи. Или пренебрегаем ими так как константа диссоциации мала, и у нас в растворе полностью распались только соли , а количество HPO4 останется неизменным? Тогда ответ не подходит (7,69 а не 7,42)
И такой раствор ведь считается base buffer, потому что H2PO4 это weak base, а HPO4- conjugate acid?
И по первому пункту у меня тоже ответ не сошелся.
1 лайк
Вы пробовали решить задачу “в лоб”? В аналитике есть универсальный способ. Он порой раскрывает глаза на более простые способы и хорошо учит заранее прикидывать что к чему.
Кстати, странно, что у вас расходуется \ce{H2PO^-_4}, но \ce{HPO^{2-}_4} при этом не прибавилось (ведь он из него образуется).
«В лоб» это как?
Да, пересчитала когда стало 12 ммоль HPO4, но стало еще хуже : pH=7,81
Вы всё правильно решали, у них в условии ошибка, вместо 30 мл, должно быть 300 мл
1 лайк