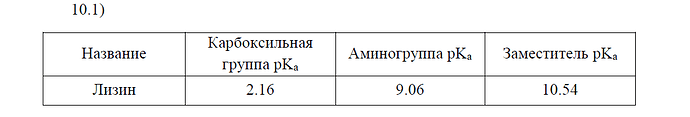
Почему то не понимаю решения таких задач про pH
Решал но в ответе вообще другое число
Давай попробуем разобраться в чём проблемы у тебя, первое что тебе надо сделать, это выполнить эти два пункта:
- Написать все значимые равновесия в системе, у тебя их четыре штуки (для шарящих пункт не обязательный)
- Нарисовать себе где-нибудь распределение для доли форм лизина в зависимости от pH
Дальше можно с полпинка решить задачу, пользуясь приближениями из химических соображений, или пойти и найти приближения используя простую математику
Сделал ли ты какой-нибудь из пунктов? Особенно интересует второй
Да я сделал 1 и 2 пункт, всё было понятно.
мне не понятно расчёты
Если ты правильно набросал график доли форм для лизина
То заметишь, что при pH=9.5 там плавает целых три формы кислоты, а именно \ce{HA, H2A^+,A^-}
При этом концентрации ионов \ce{H+,OH-} сильно меньше, поэтому у нас развязываются руки:
1. Грубый расчет
Берем только \ce{HA, H2A^+} на остальное забиваем, в таком случае у нас остается только одно равновесие (можно как вариант воспользоваться формулой \displaystyle pH=pK_a+\lg \frac{C_c}{C_к})
Подставляем в уравнение константу и концентрацию \ce{H+} и находим, что соотношение \ce{HA, H2A^+}
Т.к. у нас изначально в растворе плавало \ce{H3A^2+} то находим обычным образом количество \ce{KOH} через реакции
2. Расчет поточнее
Берем учитываем ТРИ формы \ce{HA, H2A^+,A^-}, для этого запишем уравнение электронейтральности, и раз у нас изначально плавала самая кислая форма, там какой-то анион есть изначально \ce{Cl-, SO_4^2-} и т.п. обозначу просто как \ce{X-}
Ну мы уже договорились о трех формах кислоты, значит выкидываем лишнее и остается
Если теперь выразить \ce{H2A^+,A^-} через долю форм, и перейти от концентраций к молям, то опять всё решается просто
3. Излишне точное решение
Рассчитаем все доли форм кислоты в конечном растворе, не пренебрегаем вообще ничем
Дальше всё подставляется в уравнение электронейтральности, учитывается разбавление, и находится ответ, но если ты видишь эти цифры, ты уже должен понимать, что он не будет отличаться от предыдущего ответа, больно мелкие концентрации у \ce{OH-,H3A^2+,H+}
Но если сильно хочется, ответ с учетом разбавления
Спойлер
Спасибо большое! Теперь понял. ![]()
Можно ли взять HA,H2А+ не рисуя график с помощью значений pKa в таблице. Я понял так что в диапазоне pH до 9.5 может находиться HA,H2А+ от значения pKa
Если ты хорошо всё понимаешь, то можно, но зачем? Ведь график без расчетов можно нарисовать за 10 секунд. Пересечения кривых происходят в точках, где pK=pH, даже я себе его схематично набрасываю первым делом для решения таких задач, чтобы не запутаться в формах.
А когда тебе pH дают сразу, то ты вообще можешь сразу все доли форм найти заранее, т.е. вообще только математикой пользоваться и не задумываться (что конечно тоже вредно, и просто отнимет время на олимпиаде).
А там ответ получен с каким приближением?